Die Bestimmung und Interpretation biologischer Strukturen auf atomarer Ebene ist ein wesentlicher Bestandteil der biopharmazeutischen Industrie und der biowissenschaftlichen Forschung und Entwicklung, mit Anwendungen in:
Die Berücksichtigung verschiedener Ansätze zur Strukturbestimmung ermöglicht es uns, für jedes Zielprotein die beste Methode zu verwenden, von einzelnen kleinen Proteinen bis hin zu komplexen interzellulären Anordnungen.


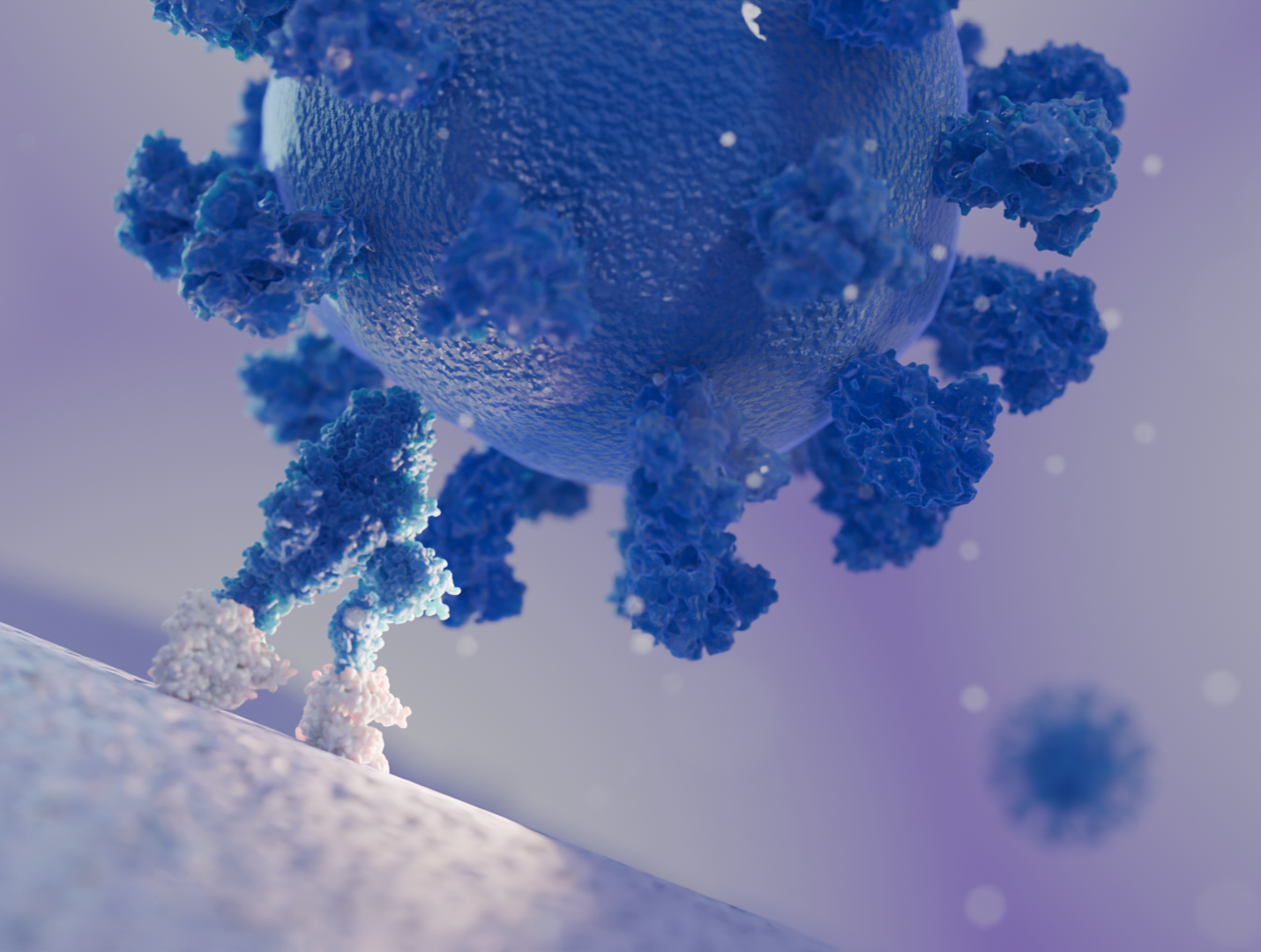
Hier mehr über die neuesten Fortschritte in der Wirt-Pathogen-Forschung von Cryo-ET erfahren.
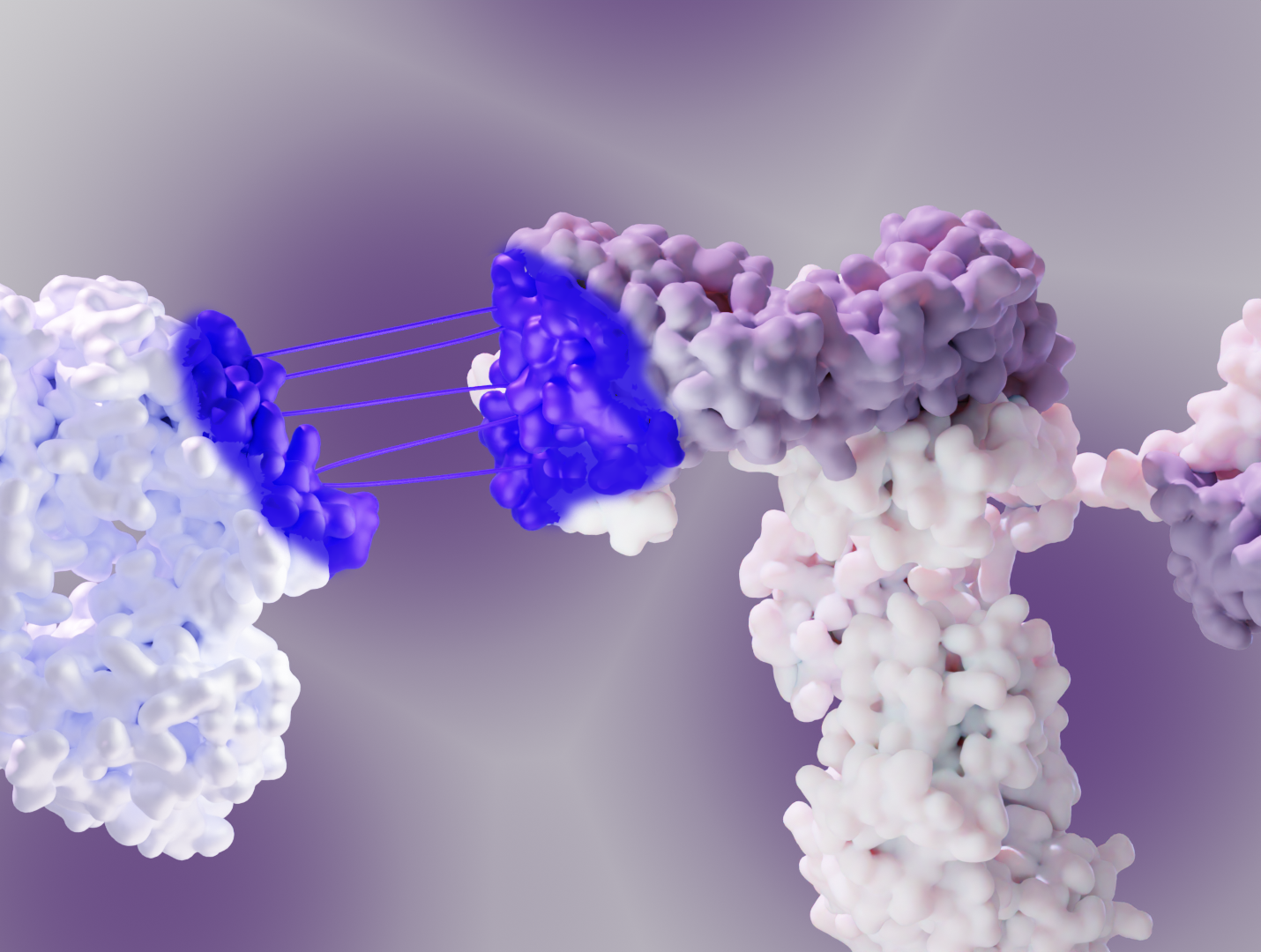
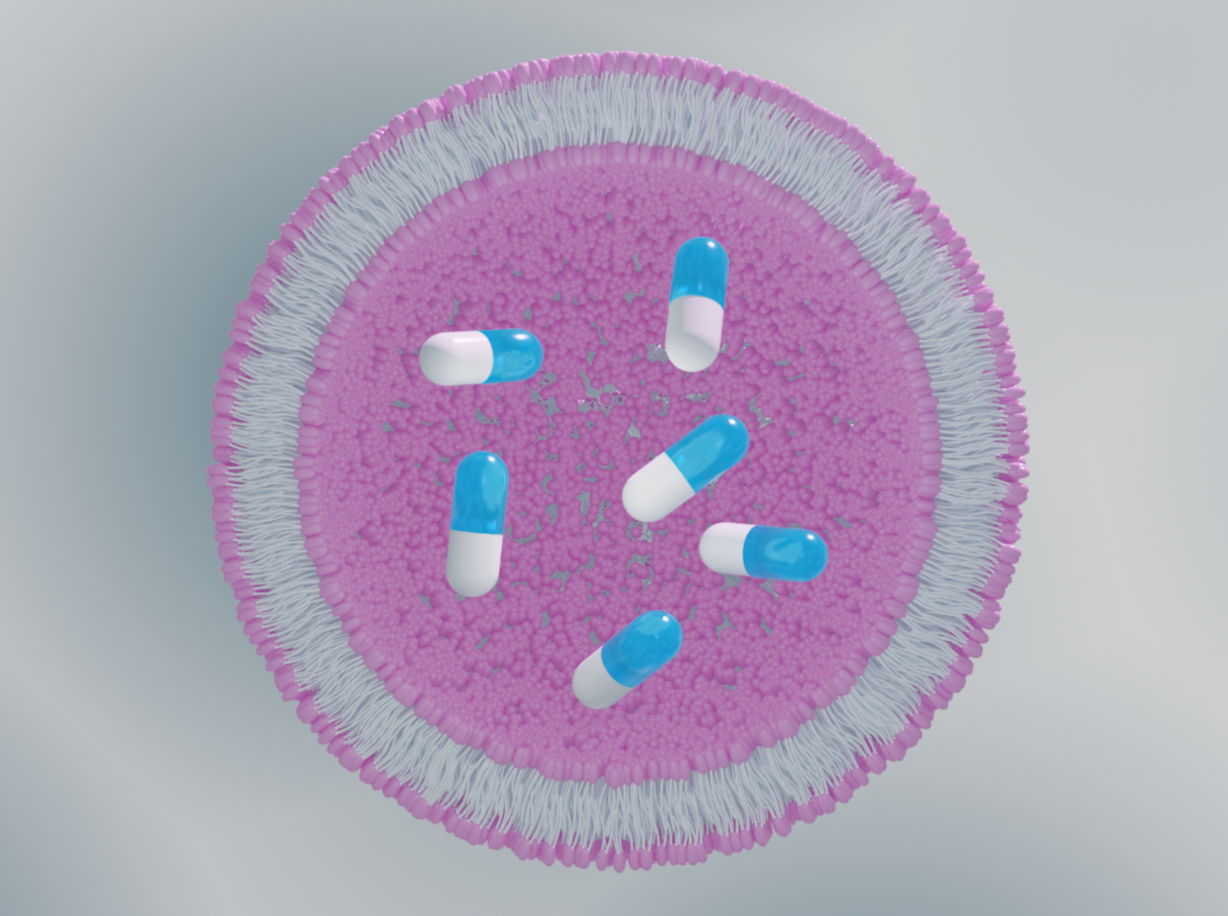
Structural biology approaches grant knowledge of the vector’s loading state, morphology, and distribution, which are all key to successful drug delivery vector development.

Vorhersagen bleiben jedoch reine Prognosen, bis sie durch experimentelle Methoden validiert werden. Strukturbiologische Experimente gewährleisten die Genauigkeit und Anwendbarkeit von KI-vorgesagten Proteinen in realen Szenarien, was besonders im Bereich der Biopharmazeutika wichtig ist.


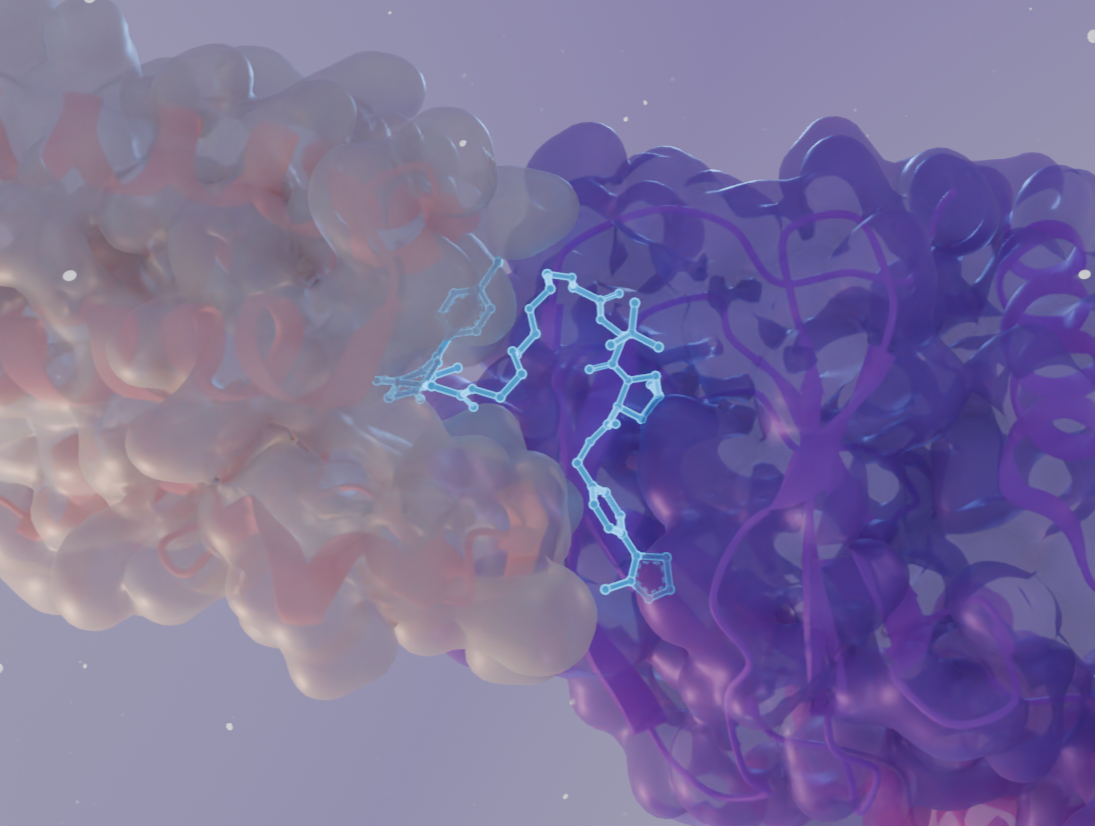
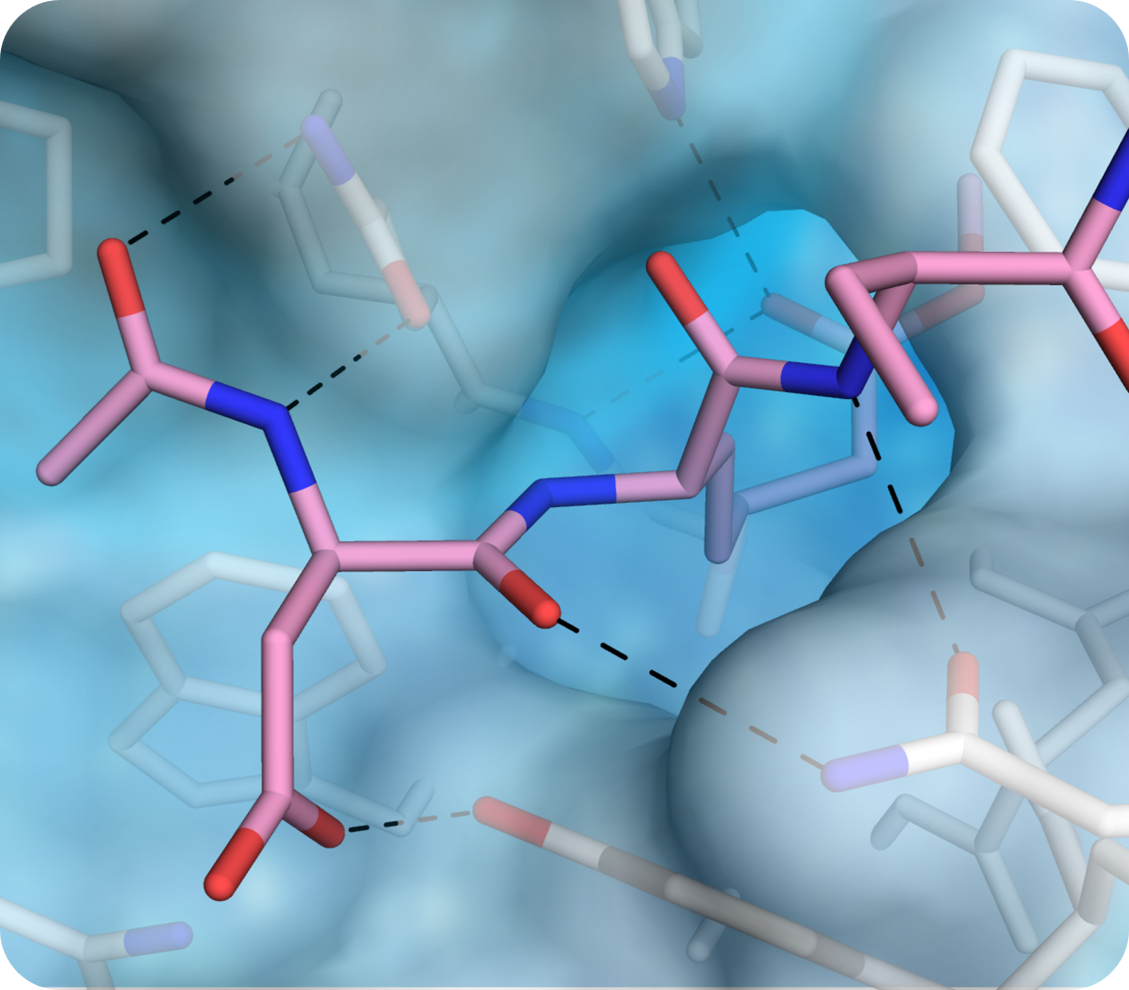
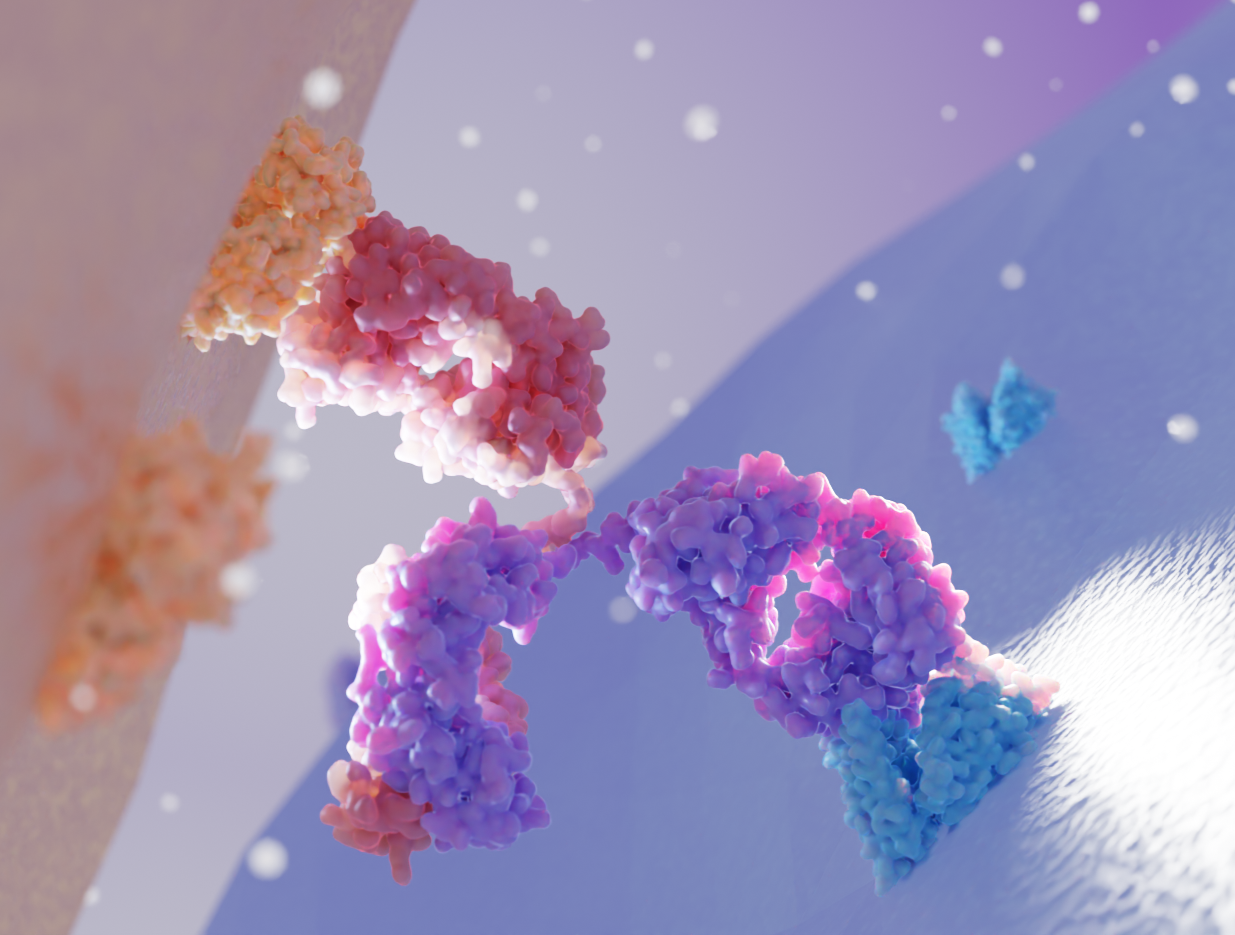
Die Strukturbiologie bietet hochauflösende Einblicke in Protein-Protein-Wechselwirkungen, Ligandenbindung und den Aufbau von Komplexen und ermöglicht so den rationalen Entwurf dieser Moleküle.
Röntgenkristallographie und Kryo-EM helfen dabei, die ternären Komplexe sichtbar zu machen, die sich zwischen dem Zielprotein, der E3-Ubiquitin-Ligase und dem PROTAC-Molekül bilden. Auf diese Weise können Forschende die Länge und Ausrichtung des Linkers für eine effiziente Ubiquitinierung und den anschließenden Abbau optimieren.